Bioequivalencia

¿Qué entendemos por Bioequivalencia de Medicamentos?
El desarrollo de medicamentos en los últimos 50 años ha permitido la obtención de notables mejoras en la salud humana. La calidad, seguridad y eficacia, así como las Buenas Prácticas de Manufactura (BMP), y las Buenas Prácticas de Laboratorio (BPL), son exigencias implantadas en la industria farmacéutica en la mayoría de los países.
El propósito de la bioequivalencia es demostrar que dos medicamentos que contengan el mismo principio activo en la misma dosis, son equivalentes en términos de calidad, eficacia y seguridad en el paciente usuario.
La aparición y desarrollo de las especialidades farmacéuticas genéricas en los últimos 35 años ha acompañado al desarrollo de los estudios de Biodisponibilidad y Bioequivalencia in vivo e in vitro (Bioexención). Estos estudios principalmente farmacocinéticos constituyen el estándar para que los organismos regulatorios en materia farmacéutica asuman la equivalencia terapéutica.
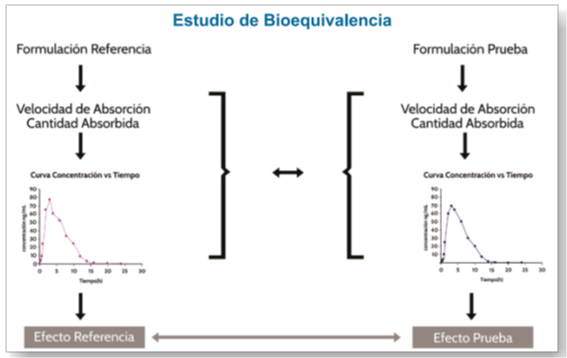
En un estudio de Bioequivalencia se busca demostrar que dos productos (un fármaco patron vs un genérico o multifuente con la misma composición y forma farmacéutica) son Bioequivalentes mediante la realización de un estudio farmacocinético comparativo en seres humanos. En este estudio se miden los parámetros farmacocinéticos como el área bajo la curva (AUC), la concentración máxima (Cmax) y el tiempo máximo (Tmax). El objetivo de este estudio es demostrar que la farmacocinética de un producto es similar a la del otro permitiendo asumir que presentaran de la misma forma, efectos farmacológicos igualmente semejantes.
Actualmente la OMS considera los estudios de Bioequivalencia como uno de los métodos para demostrar intercambiabilidad terapéutica entre dos productos farmacéuticos.
En nuestro país, el Decreto Supremo N° 024-2018-SA “Aprueba el Reglamento que regula la intercambiabilidad de medicamentos”. Publicado: 15 de Setiembre del 2018, de esta manera, el 16 de marzo de 2019 entro en vigencia el presente reglamento publicándose en forma paulatina el listado de medicamentos comercializados en el Peru que requerirán estudios de Bioequivalencia para demostrar su eficacia y seguridad y garantizar su adecuado uso.